【管理番号30-021】チタンブリッジによる甲状軟骨形成術2型の標準化と開発・海外展開
計画名
チタンブリッジによる甲状軟骨形成術2型の標準化と開発・海外展開
申請区分:海外市場獲得
事業概要
内転型痙攣性発声障害には根本的治療法がなく、対症療法としてA型ボツリヌス毒素の内喉頭筋への局所注入があるが、効果が限定的で持続期間は一時的(3~4ヵ月)であり、永続的な治療法が望まれていた。
チタンブリッジを用いた甲状軟骨形成術2型手術は、内転型痙攣性発声障害に対する症状根治治療として、世界に先駆けて日本で開発された日本独自の医療技術であり、海外では未だどの国・地域においても薬事承認に至っていない。
事業化する医療機器等の概要
事業コンセプト

製品1
基本情報
| 製品名 | チタンブリッジ | 一般的名称 | 甲状軟骨固定用器具 |
|---|---|---|---|
| クラス分類 | クラスⅢ | 許認可区分 | 承認 |
| 申請区分 | 新医療機器 | 承認・認証番号等 | - |
| 薬事申請予定者 | ノーベルファーマ株式会社 | 製販業許可 | 取得済み |
製品2
基本情報
| 製品名 | スペーサ(仮名) | 一般的名称 | 未定 |
|---|---|---|---|
| クラス分類 | 未定 | 許認可区分 | 未定 |
| 申請区分 | 未定 | 承認・認証番号等 | - |
| 薬事申請予定者 | ノーベルファーマ株式会社 | 製販業許可 | 取得済み |
製品3
基本情報
| 製品名 | スプレッダー(仮名) | 一般的名称 | 開創器 |
|---|---|---|---|
| クラス分類 | クラスⅠ | 許認可区分 | 届出 |
| 申請区分 | 後発医療機器 | 承認・認証番号等 | - |
| 薬事申請予定者 | ノーベルファーマ株式会社 | 製販業許可 | 取得済み |
製品4
基本情報
| 製品名 | 甲状軟骨3Dモデル(仮名) | 一般的名称 | - |
|---|---|---|---|
| クラス分類 | 非医療機器 | 許認可区分 | - |
| 申請区分 | - | 承認・認証番号等 | - |
| 薬事申請予定者 | ノーベルファーマ株式会社 | 製販業許可 | 取得済み |
上市予定
| 国内市場 | 海外市場 (具体的に:米国・欧州(独・英・仏)) | |
|---|---|---|
| 薬事申請時期 | 2017年 | 2020年(米国) 2018年(欧州) |
| 上市時期 | 2017年 | 2021年(米国) 2019年(欧州) |
事業成果
コンソーシアム体制
実証事業コンソーシアム構成イメージ
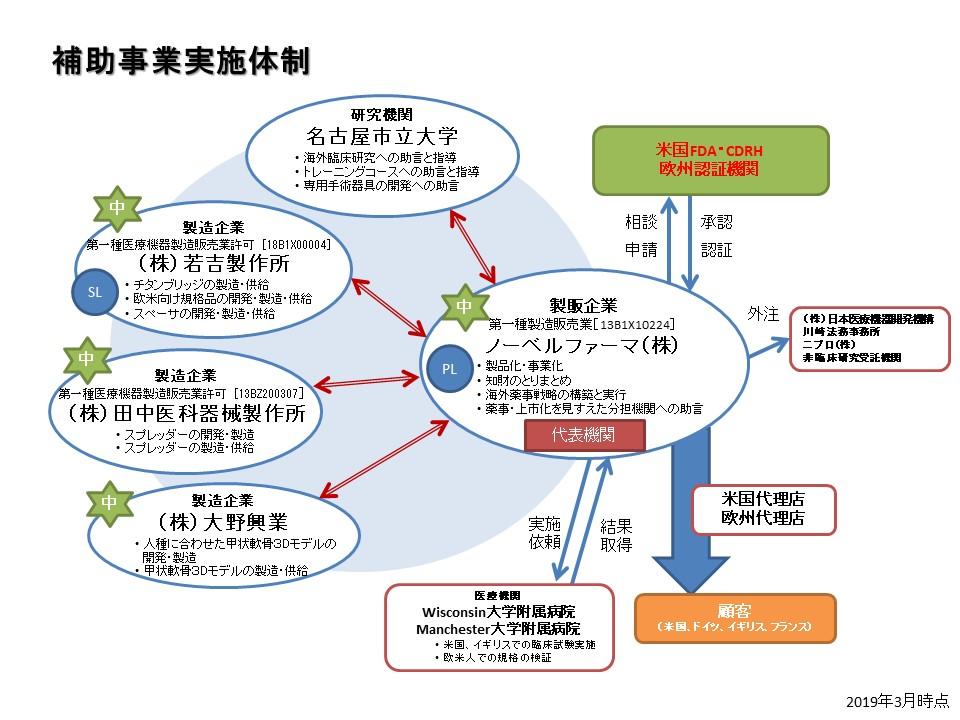
実証事業コンソーシアム構成メンバー
| 代表機関 | 分担機関 |
|---|---|
| ノーベルファーマ株式会社 | 株式会社若吉製作所 公立大学法人名古屋市立大学 株式会社田中医科器械製作所 株式会社大野興業 |

